近日,在中国北京召开的第25届CSCO(中国临床肿瘤协会)年会学术周大会上,来自北京大学肿瘤医院的李健教授口头报告了全球首款皮下注射PD-L1抗体恩维达®(恩沃利单抗注射液)治疗既往至少一线治疗失败的MSI-H/dMMR晚期实体瘤疗效和安全性的更新数据,以及对年龄和治疗时间亚组的临床数据。该药物对老年患者和年轻患者有相似的治疗获益,验证了该药物临床上的差异化优势。

恩维达®(恩沃利单抗注射液)一年前获得国家药品监督管理局的批准上市,是bet356在线登录官网(2096.HK)与思路迪医药、康宁杰瑞生物制药(9966.HK)三方战略合作的全球首个皮下注射PD-L1抗体药物,本次对批准试验更新的有效性和安全性数据以及年龄和治疗时间亚组数据进行报告。
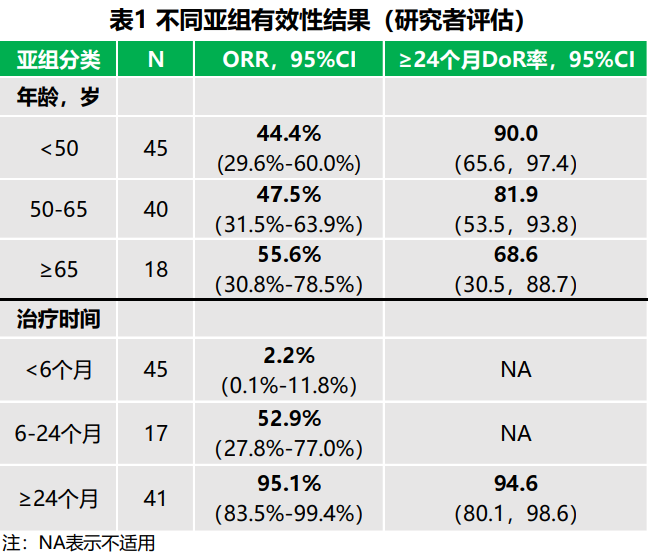
更新后的疗效分析表明,在103例受试者中,末例受试者的随访时间长达26.8个月,研究者评估结果如下:
◇ 经确认的客观缓解率(ORR)为47.6%
◇ 24个月缓解持续时间(DoR)率为82.2%
◇ 中位无进展生存期为16.6个月
◇ 24个月总生存率为66.5%
随着治疗时间和随访时间的延长,恩维达®单药治疗既往至少一线治疗失败的晚期MSI-H/dMMR实体瘤获益仍然显著,具有明显持久的临床获益。
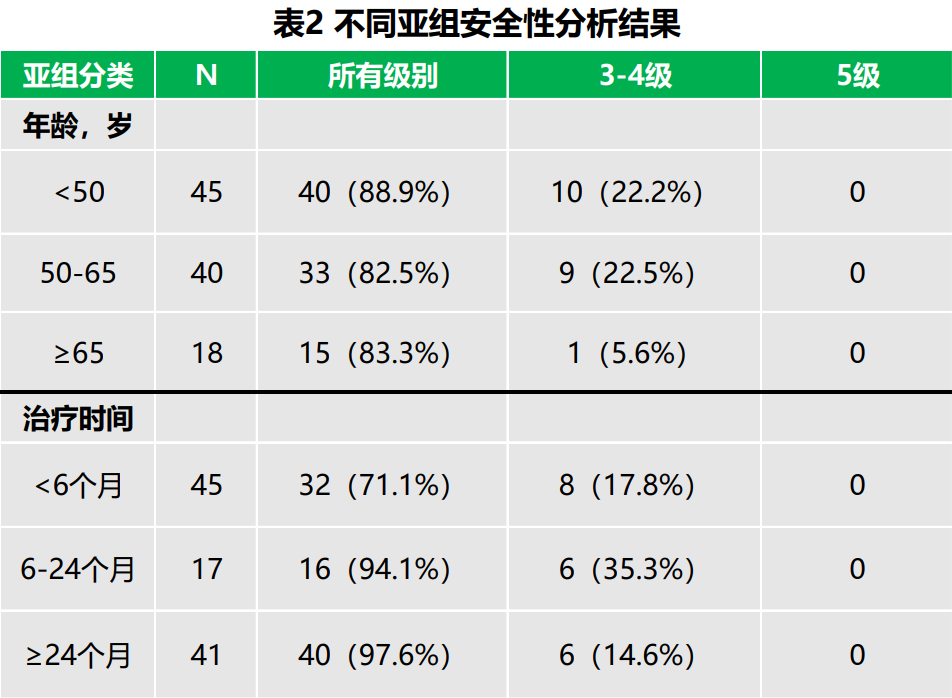
在安全性方面(表2所示),恩维达®长时间治疗仍具有良好的安全性和耐受性,无新增新的特有的安全性信号。全部受试者中,所有级别和3-4级药物相关的治疗期间不良事件(TRAE)发生率分别为85.4%和19.4%,无5级TRAE发生。
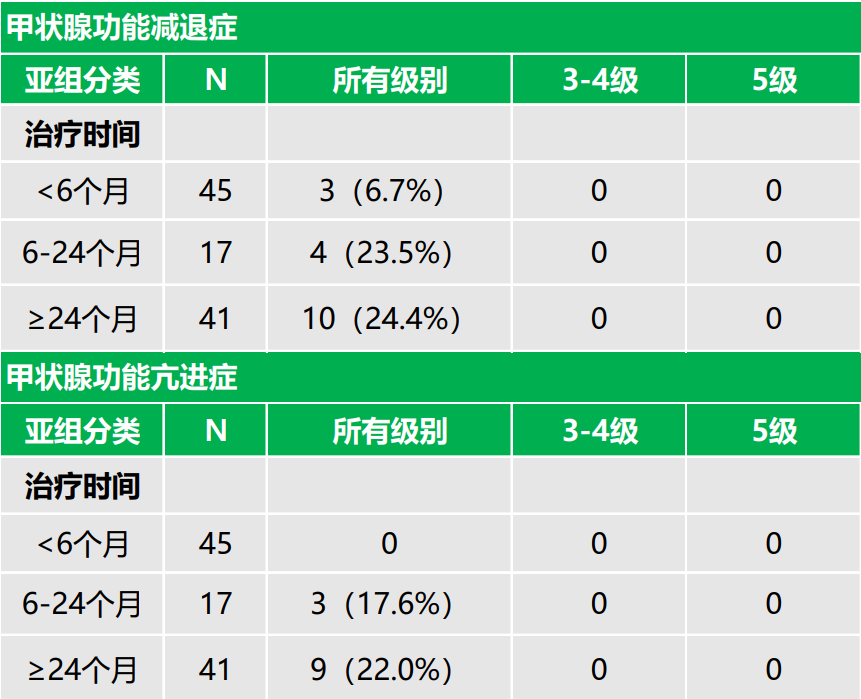
亚组分析中,<50岁、50-65岁和≥65岁年龄亚组所有级别TRAE发生率分别为88.9%、82.5%和83.3%;3-4级TRAE发生率分别为22.2%、22.5%和5.6%,提示年龄与TRAE的发生无明确相关性,在高龄患者安全性良好。< 6个月、6-24个月和≥24个月治疗时间亚组所有级别TRAE发生率分别为71.1%、94.1%和97.6%;3-4级TRAE发生率分别为17.8%、35.3%和14.6%。各治疗时间亚组甲状腺功能减退症的发生率分别为6.7%、23.5%和24.4%,甲状腺功能亢进症发生率分别为0%、17.6%和22.0%,提示随着治疗暴露时间的延长,内分泌不良事件的发生率也在增加,与同类产品报道的现象一致。亚组分析显示,老年患者具有与年轻患者相似的治疗获益风险比。
本次试验数据的更新进一步证明恩维达®在治疗其首个获批适应症——既往至少一线治疗失败的MSI-H/dMMR晚期实体瘤方面有着显著且持久的疗效,且该药物对老年患者和年轻患者有相似的疗效和安全性,加之皮下注射的给药方式所带来的独特便捷性,进一步验证了该药物在临床上针对老年患者等特殊人群可能具有的差异化优势。恩维达®各项适应症的相关试验正逐步开展中,其中多项试验已进入注册/临床III期,相信未来将继续给患者带来更多更优质的治疗选择。